



Chemische Energie kann bei Verbrennung eines Stoffs in Wärmeenergie umgewandelt werden. Die Umwandlung chemischer in elektrische Energie erfolgt in Brennstoffzellen und in Galvanischen Zellen (Batterien, Akkumulatoren). Galvanische Zellen bestehen aus zwei Elektroden und einem Elektrolyten. Der Name geht auf den italienischen Arzt Luigi Galvani zurück. Er entdeckte, dass ein mit Instrumenten aus Metallen berührter Nerv eines Froschschenkels Muskelzuckungen auslöst. Die Umwandlung chemischer Energie in elektrische Energie ist für nicht (wieder) aufladbare Batterien nicht umkehrbar. Akkumulatoren können jedoch sehr oft wieder aufgeladen werden. Dabei wird die elektrische in chemische Energie umgewandelt, aus der beim Entladen wieder elektrische Energie entsteht.
Im "Buch der Synergie" kann man nachlesen, dass es elektrische Energiespeicher schon vor über zweitausend Jahren gab. Der deutsche Mediziner und Physiker Wilhelm Josef Sinsteden und der französische Physiker Raymond Louis Gaston Planté erzielten in den Jahren 1954 bzw. 1859 wesentliche Fortschritte bei der Entwicklung eines Blei-Akkumulators. 1886 ließ sich Henri Tudor einen technisch einsetzbaren Bleiakku patentieren, so wie er bis heute noch als Autobatterie verwendet wird.
Im Englischen benutzt man im Zusammenhang mit der Speicherung elektrischer Energie nur das Wort battery und unterscheidet gelegentlich zwischen primary battery oder primary cell und secondary battery oder rechargeable battery. In einigen Fällen wird in der deutschen Sprache zwischen Batterie und Akkumulator (Akku) unterschieden. Zum Beispiel liefert die nicht wieder aufladbare Zelle einer kleineren Batterie die Spannung von 1,5 V, während der in der Bauform gleiche aber teurere und wieder aufladbare Akku eine Spannung von 1,2 V hat. Die Unterscheidung zwischen Batterie und Akku wird aber nicht streng eingehalten, und man beobachtet auch im Deutschen eine Anpassung an den englischen Sprachgebrauch. Wir verwenden hier weiter das Wort Bleiakku und bezeichnen aber alle anderen aufladbaren Speicher ebenfalls als Batterie.
Der Bleiakku hat im geladenen Zustand eine positiven Elektrode aus einem Bleikern und einem Mantel aus Blei(IV)-oxid (PbO2) und eine negative Elektrode aus fein verteiltem porösem Blei (Bleischwamm). Der Elektrolyt ist eine verdünnte (27-prozentige) Schwefelsäure (H2SO4). Im entladenen Zustand bestehen beide Pole aus Blei(II)-sulfat (PbSO4). Die Nennspannung einer Zelle ist 2 Volt, so dass für einen 12-V-Bleiakku 6 Zellen hintereinander geschaltet werden müssen. Beim Entladen sind die chemischen Reaktionen am negativen Pol
am positiven Pol
und insgesamt
Die Elektronen werden also am Minuspol abgegeben und am Pluspol aufgenommen. Beim Laden laufen alle Vorgänge in umgekehrter Richtung ab. Wie jeder Speicher ist auch der Bleiakku nur für eine begrenzte Zahl von Zyklen einsetzbar. Diese Zyklenzahl hängt auch vom Einsatz ab und wird zwischen 500 und 2000 angegeben. Die maximal während eines kurzen Zeitraums verfügbare Leistung (W) ergibt sich als Produkt von maximalem Strom und Nennspannung.
Ein wichtigerer Parameter ist die Kapazität der Energiespeicher, die in Amperestunden (Ah) angegeben wird. Multipliziert man diesen Wert mit der Nennspannung, erhält man die gespeicherte Energie in Wattstunden (Wh). Für einen Vergleich unterschiedlicher Speicher werden Dichten als Quotient von gespeicherter Energie und Gewicht der Speicher in kg oder Volumen der Speicher in Liter angegeben. Für die 12 V-105 Ah-Autobatterie Varta-H15 sind die Werte 43 Wh/kg und 96 Wh/L. Mit einem Batteriepreis von 150 € ergibt sich ein Preis/Kapazitäts-Verhältnis von 119 €/kWh.
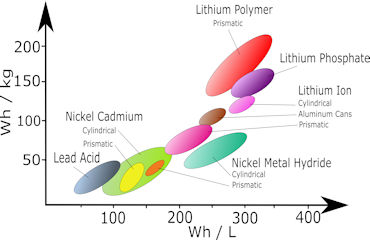
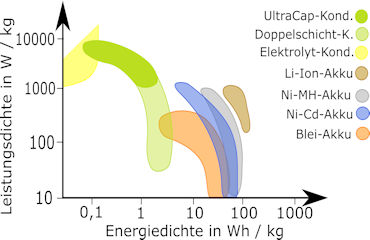
Die Abbildung links aus Wikipedia beschreibt die Energiedichte pro Gewicht als Funktion der Energiedichte pro Volumen. Letzterer Wert ist besonders für Elektroautos von Bedeutung. In der Abbildung rechts daneben ist die Leistungsdichte als Funktion der Energiedichte beschrieben.
Kondensatoren zeigen im Vergleich zu Batterien ihre Überlegenheit bei der Leistungsdichte und ihre Unterlegenheit bei der Energiedichte.
In den beiden Abbildungen folgen auf den Bleiakku die Nickel-Cadmium-Batterien. Sie wurden zu Beginn des 20. Jahrhunderts eingeführt und in Europa zu Beginn des 21. Jahrhunderts wegen des giftigen Cadmiums zunehmend vom Markt verbannt.
Nickel-Metallhydrid-Batterien (NiMH-Akkus) wurden in der zweiten Hälfte des vorigen Jahrhunderts entwickelt. Seit 2005 führte die Verbesserung der bis dahin zu hohen Selbstentladung durch Einführung der sogenannten LSD-NiMH (engl. low self-discharge NiMH battery) zu dem auch heute noch hohen Marktanteil. Die negative Elektrode besteht aus einer Legierung von den Metallen (M) Lanthan, Cer, Neodym und Nickel, die Wasserstoff als Hydrid aufnehmen und wieder abgeben können. Beim Entladen wird der Wasserstoff aus dem Metallhydrid (MH) wieder oxidiert. An der positiven Elektrode wird dreiwertiges Nickeloxidhydrat zu zweiwertigem Nickelhydroxid reduziert. Die chemischen Reaktionen beim Entladen sind am negativen Pol (Minuspol)
am positiven Pol (Pluspol)
und insgesamt
Handelsübliche wieder aufladbare NiMH-AA-Batterien mit einem Gewicht von 30 g und einem Volumen von 8 cm3 haben eine Kapazität von 1,2 V × 2000 mAh = 2,4 Wh, eine Zyklenzahl bis 2000 und einen Preis von 2 €. Daraus ergeben sich die Energiedichten von 80 Wh/kg und 275 Wh/L sowie ein Preis/Kapazitäts-Verhältnis von 833 €/kWh. Nach höchstens 2000 Aufladungen müssen die Batterien erneuert werden.
In Autos ohne Elektro-Antriebsmotor kommen meist Bleiakkus mit einer Kapazität in der Größenordnung von 1 kWh zum Einsatz. Hybridautos haben neben einem Benzin- oder Dieselmotor einen Elektromotor und Nickel-Metallhydrid- oder Lithium-Ionen-Batterien mit Kapazitäten in der Größenordnung von 10 kWh. Für reine Elektroautos stehen schon Kapazitäten über 50 kWh zur Verfügung, siehe Wikipedia.
Die Lithium-Ionen-Batterie, die erstmals 1991 von Sony auf den Markt gebracht wurde, erreicht mehr als 100 Wh/kg. Sie hat eine Kathode (Minuspol) aus Graphit und eine Anode (Pluspol) aus Lithium-Metalloxid, meist aus LiMn2O4. Als Elektrolyt dienen Salze, wie Lithiumhexafluorophosphat (LiPF6) in wasserfreien Lösungsmitteln wie Ethylencarbonat oder für den Lithium-Polymer-Akku, siehe unten, eine feste bis gelartige Polymerfolie. Beim Laden wandern die positiv geladenen Lithium-Ionen durch den Elektrolyten hindurch von der Anode zwischen die Graphitebenen (nC) der Kathode. Der Ladestrom wird durch die Elektronen über den äußeren Stromkreis erzeugt. Die Lithium-Ionen bilden mit dem Kohlenstoff eine Interkalations-Verbindung (LixCn). Beim Entladen wandern die Lithium-Ionen zurück in das Metalloxid. Die Elektronen fließen über den äußeren Stromkreis zur Kathode. Entlade-Reaktionen sind am Minuspol
am Pluspol
und insgesamt
Seit 2017 ist das damals weltweit größte Lithium-Ionen-Batterie-Speicherkraftwerk im Windpark Hornsdale nördlich von Adelaide, Australien, in Betrieb. Seit 2020 hat es eine Gesamtleistung von 150 MW und eine Kapazität von 193 MWh. Anfang 2024 beanspruchte ein solcher Speicher in Kern County, Kalifornien, mit 1300 MW/3300 MWh die Weltspitze. Die Liste von Batterie-Speicherkraftwerken auf Wikipedia kommt der Entwicklung kaum hinterher.
Für Wohnhaus-Solaranlagen bietet Tesla seit 2017 eine Powerwall genannte flüssigkeitsgekühlte Lithium-Ionen-Batterie an. Die Kapazität ist 13,5 kWh, das Volumen 135 L und das Gewicht 120 kg. Gesamtkosten der Installation liegen bei etwa 10 000 €. Das ergeben etwa 112 Wh/kg, 100 Wh/L und 741 €/kWh. Die Lebensdauer von Lithium-Ionen-Batterien wird mit über 10 Jahren und die Zyklenzahl mit über 5000 angegeben.
Die Lithium-Polymer-Batterie gehört zu den Lithium-Ionen-Speichern. Sie hat auch eine negative Elektrode aus Graphit und eine positive aus Lithium-Metalloxid, enthält aber keinen flüssigen Elektrolyten. Der Elektrolyt auf Polymerbasis ist eine feste oder gelartige Schichtfolie, die sich preiswert mit einer Dicke von weniger als 100 Mikrometern herstellen lässt. Für Elektroautos werden Lithium-Polymer-Batterien mit einer Kapazität oberhalb von 50 kWh verwendet.
Die Natrium-Schwefel-Batterie wurde in den 1980er Jahren entwickelt, hat eine Betriebstemperatur von etwa 320 °C und erfordert eine Zusatzheizung, was eine thermische Isolierung und zusätzliche Heizsysteme notwendig macht. Die nötige Heizenergie muss zur eigentlichen (geringen) Selbstentladung zugerechnet werden. Deshalb hat man bei kleinen Systemen wegen des hohen Oberflächenanteils eine hohe Gesamtselbstentladung. Die Entladereaktion ist
Geschmolzenes Natrium in einer Metallhülle bildet die positive Elektrode. Die negative Elektrode besteht aus einem mit flüssigem Schwefel getränkten Graphitgewebe. Der Elektrolyt ist eine Natrium-leitende Aluminiumoxid-Keramik. Natrium-Schwefel-Batterien der Firma NGK Insulators haben eine Speicherdichte von 222 Wh/kg, einen optimalen Temperaturbereich 300−340 °C und eine Lebensdauer von 20 Jahren oder 7300 Zyklen. Wie auch bei anderen Batterien beeinflusst die Entladetiefe die Zahl der Zyklen. Von 2500 bei maximaler Entladung steigt die Zahl auf über 7000 Zyklen bei einer 65 %igen Entladung.
Die ZEBRA-Batterie (engl.: zero emission battery research activities)) ist eine Natrium-Nickelchlorid-Batterie. Die Betriebstemperatur ist etwa 300 °C und erfordert bei Nichtgebrauch trotz Vakuum-Wärmedämmung eine Zusatzheizung. Die Batterie wurde in den 1970er Jahren entwickelt und damals auch in Elektroautos eingebaut. Die Entladereaktion ist
Eine Redox-Flow-Batterie hat eine galvanische Zelle, in der durch eine Membran der Ionenaustausch erfolgt. Im Gegensatz zu anderen Batterien hat sie außerdem zwei getrennte Kreisläufe, in denen die beiden Energie-speichernden Elektrolyte in einem Lösungsmittel wie Schwefelsäure mittels einer Pumpe zirkulieren. In der Zelle werden die gelösten Stoffe chemisch reduziert bzw. oxidiert. Diese Batterie gibt es seit Mitte des vergangenen Jahrhunderts, und Ende des Jahrhundert wurde die jetzt vorherrschende Vanadium-Redox-Flussbatterie eingeführt. Beim Entladen wird an der negativen Elektrode Vanadium(II) zu Vanadium(III) oxidiert
und an der positiven Elektrode das Vanadium(V)-oxid-Ion zum Vanadium(IV)-oxid-Ion reduziert
Eine Besonderheit für die Anwendung ist, dass man durch Veränderung des Speichervolumens für die Elektrolyte die Kapazität des Speichers (Energieinhalt) unabhängig von der Leistung variieren kann. Trotzdem ist die Energiedichte mit etwa 30 Wh/Liter gering und mit der des Bleiakkus vergleichbar. Einen Überbblick über Entwicklungsstand und Anwendungen Anfang 2021 gibt der Review Redox Flow Batteries: Stationary Energy Storages with Potential von J. Gierschik u.a.
Batteriespeicher mit Energiedichten über 300 Wh/kg befinden sich noch im Entwicklungsstadium. Ein Kandidat ist die Aluminium-Batterie.
Die weiteren Entwicklungen werden zeigen, welcher Batterietyp mehr als 300 Wh/kg speichern kann und für den Dauerbetrieb in Energiespeichern und Elektroautos geeignet ist.