

In der Thermodynamik stellt die Innere Energie U die Summe aller Energieformen eines Systems dar. U kann nur verändert werden, wenn von außen Energie oder Materie zugeführt wird. Zugeführte Wärme dQ und zugeführte Arbeit dW sind gleich der Änderung der Inneren Energie des Systems:
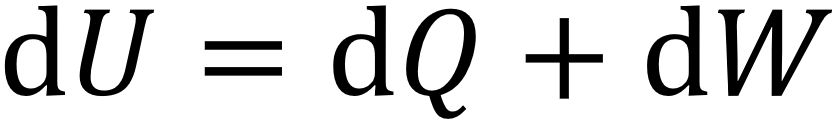
In einem abgeschlossenen System ist dU = 0, und obige Gleichung kann als Energieerhaltungssatz dQ = −dW zwischen Wärme und Arbeit angesehen werden.

Im Jahre 1842 fand Robert von Mayer, dass Wärme und mechanische Energie in einem festen Verhältnis ineinander überführt werden. Heute steht diese Gleichung für den ersten Hauptsatz der Thermodynamik, und eine der dafür gebräuchlichen Formulierungen ist:

Die von einem System mit seiner Umgebung ausgetauschte Summe von Arbeit und Wärme ist gleich der Änderung der Inneren Energie des Systems.
Der zweite Hauptsatz der Thermodynamik (Entropiesatz) schränkt die Umsetzung thermischer Energie in Arbeit ein. Carnot hatte diese Einschränkung bereits im Jahre 1824 gefunden. Eine heute in der Wissenschaft gebräuchliche Formulierung des Sachverhalts ist:
Die Entropie S kann in einem abgeschlossenen thermodynamischen System nur zunehmen oder bei umkehrbaren (reversiblen) Prozessen höchstens gleichbleiben:
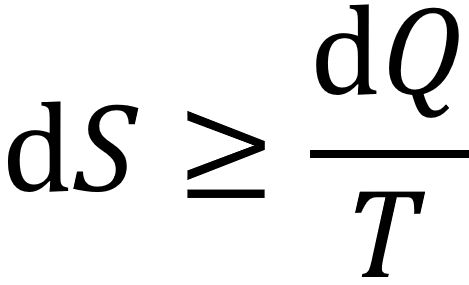
Die gleiche Bedeutung hat die Aussage, dass es ist nicht möglich ist, eine Maschine zu bauen, die kontinuierlich Arbeit leistet, indem sie einem System Wärme entzieht. Eine solche Maschine bezeichnet man als "Perpetuum Mobile zweiter Art". Dem ersten Hauptsatz der Thermodynamik würde diese Maschine, die nur Wärme verbraucht und vollständig in mechanische oder elektrische Energie umwandelt, nicht widersprechen.
Deshalb kann man den zweiten Hauptsatz auch so formulieren:
Ein Perpetuum Mobile zweiter Art ist unmöglich.
Die Formulierung von Kelvin und Planck lautet:
Es gibt keine Zustandsänderung, deren einzige Ergebnisse das Abkühlen eines Körpers und das Heben eines Gewichtes sind.
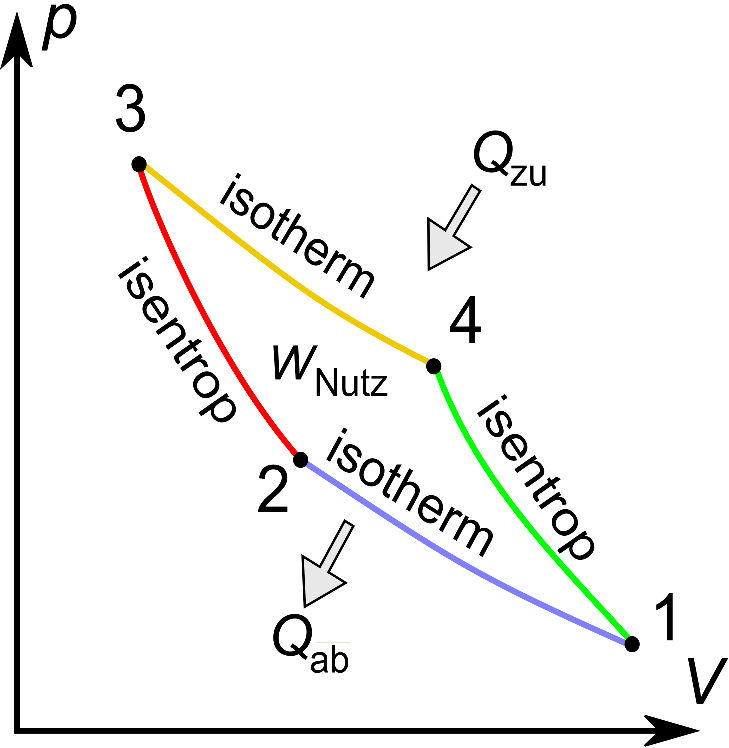
Der reversible Carnot'sche Kreisprozess beschreibt eine kontinuierlich arbeitende Maschine mit dem größten theoretisch möglichen Wirkungsgrad. Im Druck-Volumen-Diagramm (p-V) eines idealen Gases im Carnot-Zyklus (links) wird von zwei Isothermen (Linien gleicher Temperatur) und zwei Isentropen (Linien gleicher Entropie) die Fläche der Nutzenergie (Exergie) WNutz eingeschlossen. Die zugeführte Wärme ist durch Heizung aufzubringen, die abgeführte Wärme geht durch Kühlung verloren. Weil die Isentropen reversibel durchlaufene Adiabaten sind, das heißt, es findet kein Energieaustausch mit der Umgebung statt, haben wir im Kreis 1, 2, 3, nach 4 zuerst isotherme Kompression und Wärmeabgabe an das Kühlmittel (Kondensat-Temperatur Tc), danach adiabatische Kompression, danach isotherme Expansion und Wärmeaufnahme aus dem geheizten Reservoir (Temperatur Th) und zuletzt adiabatische Expansion.
Beim Durchlaufen der Isotherme wird die Wärme Qzu = Th ΔS zugeführt, beim Kühlen die Wärme Qab = Tc ΔS abgeführt. Die Differenz entspricht der geleisteten Arbeit WNutz. Damit ist der Wirkungsgrad η, das Verhältnis von Nutzenergie zur aufgewendeten Energie,
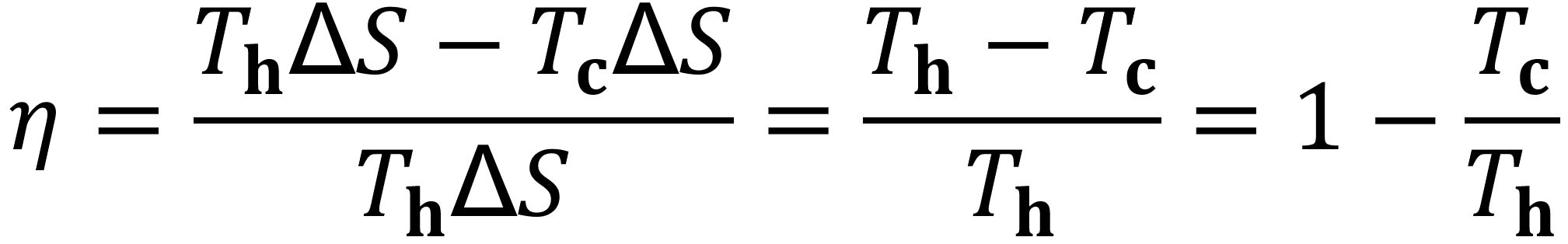
Nimmt man als Kühlmitteltemperatur 20 °C und als heiße Temperatur siedendes Wasser bei 100 °C, ergibt sich aus 293,15 K / 373,15 ≈ 0,79 ein Wirkungsgrad von 21 %. Reale Kreisprozesse haben einen niedrigeren Wirkungsgrad als der Carnot-Prozess.