


Email: kathrin.jaeger@medizin.uni-leipzig.de
 |
Core Unit Fluoreszenz - Technologien |  |
 |
Anwendungen |  |
| Kontakt: Dipl.-Biochem.
Kathrin Jäger; Tel.: 0341-9715974/15944;
Email: kathrin.jaeger@medizin.uni-leipzig.de |
 |
Anwendungsbeispiele Fluoreszenzfarbstoffe Probenvorbereitung Einzelzellsuspension objektträgergebundene Zellen Auswertung |
|
|
 |
|||
 |
|||
 |
|||
 |
|||
 |
|||
 |
|||
Anwendungsbeispiele Mit den Methoden der Durchflusszytometrie und Zellsortierung und der objektträgergebundenen Zytometrie (LSC) sind zahlreiche Analysen möglich, z. B.: - Zellproliferation - Zelltod (Apoptose, Nekrose) - Zellfunktion (Chemotaxis, Phagozytose, Burst, Degranalation, Zytotoxizität,...) - Zellsekretion (Zytokine, Chemokine, Wachstumsfaktoren) - Antigenmuster - Rezeptorstatus / -affinität (Ligandenbindung) - Aktivierung (Calciumeinstrom, Aktivierungsantigene) - Immunphänotypisierung - Chromosomenzählung und -sortierung - Klonierungsversuche - Gewebeschnittanalyse (nur LSC) - Gewebe Microarray Analyse (nur LSC) - Charakterisierung adherenter Zellen (nur LSC) Fluoreszenzfarbstoffe (Beispiele) 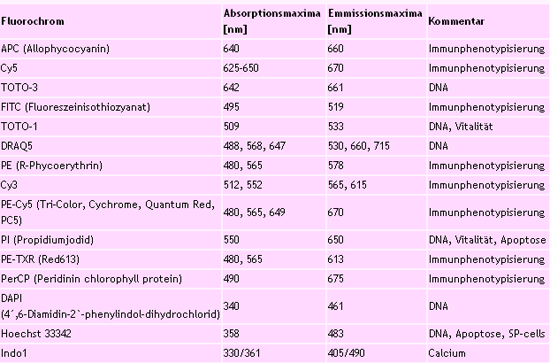 Probenvorbereitung Nachdem Sie mit den Mitarbeitern der Core Unit Termin und Inhalt der gewünschten Analysen oder Zellsortierungen abgesprochen und einen Aufrag (siehe downloads) ausgelöst haben, beginnt die Probenvorbereitung. Zu beachten ist, dass die Labore der Core Unit dem Sicherheitsstandard S1/L1 genügen, deshalb nur entsprechende Proben bearbeitet werden. Die Zellsorter arbeitet mit einem Flüssigkeitssystem, das potentiell Aerosole erzeugt. Mit diesen Aerosolen können beim Sortieren unter hohem Druck HBV, HCV, HIV oder andere infektiöse Mikroorganismen freigesetzt werden. Deshalb werden unfixierte Zellen aus humanem Gewebe nur dann sortiert, wenn sichergestellt ist, dass sie frei von infektiösen Mikroorganismen sind. Färbeprotokolle und Hinweise zum Fixieren von Zellen sind über die Mitarbeiter der Zytometrielabore erhältlich. Für jede zytometrische Analyse wird ein Blank zur Negativ-Kontrolle, dem Ausschluss von Autofluoreszenz, benötigt. Das Blank, die Kontrollprobe, enthält unbehandelte, ungefärbte und nicht transfizierte Zellen. Bei Mehrfarbenanalysen ist für jedes Fluorochrom eine Positiv-Kontrolle notwendig. Einzelzellsuspension Durchflusszytometrisch ist nur die Analyse von Einzelzellsuspensionen (ca. 1...5 x 10^6 Zellen pro ml PBS mit 0,05% BSA, FACSVantage 1 x 10^7 pro ml) möglich. Bevor mit Analysen begonnen werden kann, sind verschiedene Fragen zu klären: <ul class="standard"> <li>Welche Zellen sollen untersucht werden?</li> <li>Welche Fluoreszenzfarbstoffe sollen verwendet werden?</li> <li>Bei Mehrfarbenfluoreszenz: Wie lassen sich Überlappungen der Emissionsspektren kompensieren?</li> <li>Gibt es besondere Temperaturanforderungen?</li> <li>Ist lediglich eine Analyse geplant oder könnte im Anschluss ein Cell Sorting notwendig werden?</li> <li>Werden die sortierten Zellen wieder angezüchtet oder gleich weiterbearbeitet, z.B. zur RNA-Gewinnung?</li> <li>Sollen die Zellen die Sortierung überleben?</li></ul> Sind diese Fragen geklärt, kann entschieden werden, ob die Probe steril behandelt werden muss. Welche Hüllstromflüssigkeit (sheath fluid) verwendet wird, entscheiden die Mitarbeiter der Core Unit nach Absprache mit den Nutzern. Für die Gewinnung von RNA empfiehlt sich FACSFlow, eine optimierte sheath fluid von Becton Dickinson. Sie enthält allerdings einen Oberflächenentspanner, der Zellmembranen schädigen kann. Sollen Zellen wieder in Kultur gebracht werden, muss deshalb ein Puffer (PBS oder HBSS) verwendet werden. Objektträgergebundene Zellen Für Analysen mit dem Laser Scanning Cytometer sollten Zellen in einer Konzentration verfügbar sein, die eine mono-layer entstehen lässt, ohne dass sich Zellen überlappen oder berühren. Zur Untersuchung müssen die einzelnen Zellen an einem Objektträger oder einer optisch reinen, völlig planen und nicht fluoreszierenden Glasplatte entsprechender Größe haften. Sie dürfen sich nicht bewegen. Verwendet werden können Fluoreszenzfarbstoffe, die mit 488 und / oder 632,8 nm anregbar sind. Bei Mehrfarbenfluoreszenz sind Überlappungen der Fluoreszenzspektren zu berücksichtigen. Auswertung Bei den Messungen an den einzelnen Zytometern der Core Unit werden mit der entsprechenden Software Files in einem speziellen Flow Cytometry Standard-Format (FCS-Files) generiert. Damit können sowohl während als auch nach der Messung Histogramme einzelner Parameter oder Dot-Plots der gemessenen Parameter in beliebigen Kombinationen erzeugt werden. Statistische Auswertungen, z.B. Ermittlung der Anteile bestimmter Populationen, Bestimmung verschiedener Mittelwerte von Streulicht- oder Fluoreszenzintensitäten u.a.m., sind ebenso möglich. Nutzer erhalten auf Wunsch Ausdrucke ausgewählter Histogramme und / oder Dot Plots mit entsprechenden statistischen Angaben und / oder die Messdaten als Dateien (FCS-Files). Nach den Analysen können die Nutzer nach Absprache mit den Mitarbeitern der Core Unit selbständig weitere Auswertungen durchführen. Das FlowJo-Auswerteprogramm kann in der Core Unit genutzt werden. Auswertungen mit eigener Software sind möglich. |
|||