|
|
|
Introduction Rasterkraftmikroskopie Rasterkraftmikroskopie |
|
 |
|
 |
Rasterkraftmikroskopie (engl. "scanning
force microscopy" (SFM) oder "atomic
force microscopy" (AFM)) gehört zum Gebiet der Rastersondenmikroskopie
(engl. "scanning probe microscopy" (SPM)),
welches alle Mikroskoptechniken umfasst, die Bilder einer Oberfläche
nicht durch optische oder elektronenoptischen Abbildung, sondern durch
Wechselwirkung einer physischen Sonde mit der Probe erzeugen.
Der Vorgänger des Rasterkraftmikroskops, das Rastertunnelmikroskop
(engl. "scanning tunneling microscope" (STM)) wurde in den frühen
1980er Jahren von Gerd Binnig und Heinrich Rohrer entwickelt [1,
2],
was ihnen 1986 den Nobelpreis
in Physik einbrachte. Das erste Rasterkraftmikroskops wurde 1986 von
Binnig, Quate und Gerber erfunden [3]. Sein englischer
Name "atomic force microscopy" spielt auf die Wechselwirkung auf atomarer
Ebene zwischen Sonde und Probe an. Anziehenden Van-der-Waals-Kräfte
und Pauli-Repulsion (durch die sich überlappenden Elektronenorbitale)
können durch das Lennard-Jones-Potential beschrieben werden.
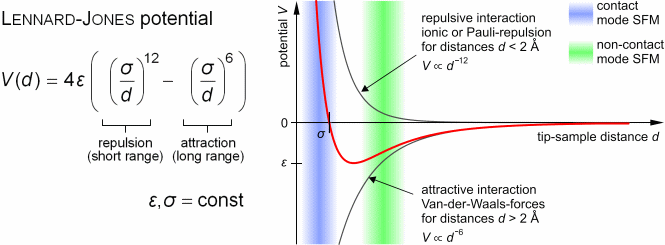 |
| (Abbildung von Steve Pawlizak, 2009.) |
|
 |
|
|
|
(Abbildung aus der Diplomarbeit von Claudia
Brunner, 2004.) |
|
|
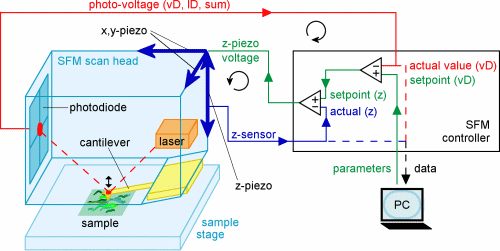
Das Rasterkraftmikroskop tastet zeilenweise die Oberfläche ab und
baut topografische Bilder auf. Ein Laser strahlt auf einen Hebelarm, den
sogenannten Cantilever, und wird von diesem auf positionssensitive Photodioden
reflektiert. Während sich die scharfe Spitze, die sich am losen Ende
des Cantilevers befindet, über die Probe bewegt, verbiegt sich der
Cantilevers relativ zum Höhenprofil der Probenoberfläche und
die Photodioden registrieren die daraus tesultierenden Positionsverschiebungen
der Laserreflexion. Zwei Piezoelemente (ein Piezoelektrisches Element dehnt
sich oder kontraktiert direkt proportional zu einer angelegte elektrischen
Spannung) sorgen dafür, dass Cantilever, Laser und Photodioden in
x- und y-Richtung über die Probe bewegt werden. Das Signal von den
Photodioden wird zu einem z-Piezo geleitet, der den Cantilever hoch oder
herunter bewegt, um die Ablenkung des Laserstrahls bzw. die Biegung des
Cantilevers wieder auszugleichen. Die Information der Ablenkung wird benutzt,
um ein Bild der Oberfläche aufzubauen.
Da ein Rasterkraftmikroskop sowohl in Luft als auch in Flüssigkeit
betrieben werden kann, ist es möglich mit lebenden Zellen unter physiologischen
Bedingungen zu arbeiten [4, 5].
Für unsere Forschung benutzen wir das NanoWizard
BioAFM (JPK Instruments AG, Berlin), bei dem der x-y-z-Scanner die
Halterung des Cantilevers (und nicht die der Probe) gekoppelt ist. Der
NanoWizard hat den großen Vorteil, dass viele Lichtmikroskopietechniken
(wie z.B. Phasenkontrast) parallel zum Rasterkraftbetrieb eingesetzt werden
können, was besonders bei der biologischen Forschung hilfreich ist.
Abbildungsmodi
Ein Rasterkraftbild gibt die Topografie einer Oberfläche wieder
und zur Erstellung einer 3d-Darstellung genutzt werden.
Es gibt verschiedene Abbildungsmodi, die in erster Linie in statischen
Modus (Contact Mode) und dynamische Modi (Non-Contact und Intermittent
Contact Mode) mit oszillierender Sonde unterschieden werden. Die beiden
am häufigsten verwendeten Modi, um Proben mit einem Rasterkraftmikroskop
abzubilden, sind der Contact und der Intermittent Contact Mode. Während
im Contact Mode die Cantilever-Spitze über die Probenoberfläche
kratzt, vibriert der Cantilever im Intermittent Contact Mode und tippt
so Punkt für Punkt auf die Probe.
Kraft-Spektroskopie
|
 |
|
|
|
(Abbildung aus der Diplomarbeit von Steve
Pawlizak, 2009.) |
|
|
Neben dem Abbilden von Oberflächen gibt es eine weiter bedeutende
Anwendung der Rasterkraftmikroskopie: die Kraft-Spektroskopie. Dabei wird
der Cantilever an einem Punkt in die Probe gedrückt und anschließend
wieder zurück gezogen. Während dieses Vorgangs wird die Höheninformation
des z-Piezos und die vertikale Verbiegung des Cantilevers aufgenommen.
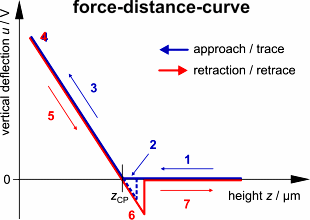
Das Resultat ist eine sogenannte Kraft-Abstands-Kurve (da die Verbiegung
eng mit der auf den Cantilever ausgeübten Kraft verbunden ist). Genauer
gesagt, produziert jeder Scan zwei Kurven. Eine zeigt die Cantilever-Biegung
u
in Abhängigkeit von der Höhe z während der Annährung
des Cantilever an die Probe (trace-Kurve) und die andere während des
Zurückziehens des Cantilevers (retrace-Kurve). Auf einem quasi-unendlich
harten Untergrund (wie z.B. ein Deckgläschen) wird ein charakteristischer
Graph produziert, der im Folgenden diskutiert wird.
Trace: Zunächst wird
der Hebel abwärts bewegt, ohne dass die Probe berührt wird. Also
wird noch keine Verbiegung sondern nur eine abnehmende Höhe des Hebels
gemessen (1). Sehr dicht über der Oberfläche kann der Cantilever
plötzlich durch Adhäsionskräfte (z.B. elektrostatische Wechselwirkung)
von der Probe angezogen werden, d.h. er schnellt herunter bis zum Kontakt
und wird so ein wenig nach unter gebogen (2). Wenn der Cantilever weiter
herunter bewegt wird, biegt sich sein loses Ende aufwärts proportional
zur Abwärtsbewegung seines fixierten Endes (z-Piezo-Höhe) (3).
Dieser charakteristische lineare Anstieg kann zur Kalibrierung des Cantilevers
verwendet werden.
Retrace: Sobald eine vorgegebene
Verbiegung erreicht ist (4), wird der Cantilever zurückgezogen. Der
Cantilever entspannt sich, während sein fixiertes Ende wieder angehoben
wird (5). Dann bleibt die Spitze für gewöhnlich durch Adhäsion
am Untergrund haften, was den Cantilever in die andere Richtung (abwärts
statt aufwärts) verbiegt, bis die Spitze plötzlich losreißt
und der Cantilever in seine Ausgangsposition zurückschnellt (6). Das
weitere Zurückziehen bewirkt keine vertikale Verbiegung mehr (7).
Wenn der Cantilever kalibriert ist, also seine Sensitivität s
und Federkonstante k bekannt sind, kann man die angewendete Kraft
F,
welche proportional zur vertikalen Verbiegung u des Cantilevers
ist, errechnen.
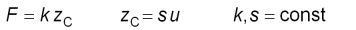
Messung elastischer und viskoelastischer Eigenschaften
|
 |
|
|
|
(Abbildung von Claudia Brunner und Steve Pawlizak,
2004, 2009.) |
|
|
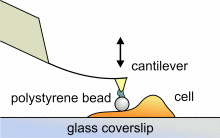
Mittels Rasterkraftmikroskopie können auch lokale elastische und viskoelastische
Eigenschaften von weichen Proben wie biologischen Zellen gemessen werden.
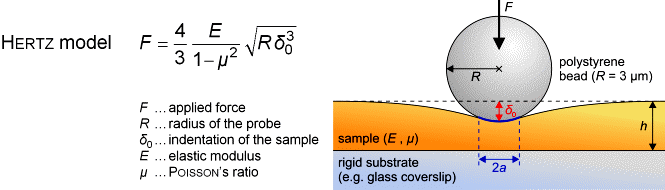
Das Elastizitätsmodul E kann durch Aufnahme und Analyse von
Kraft-Abstand-Kurven bestimmt werden. Um Beschädigungen von lebenden
Zellen während der Messung zu verhindern und um eine wohldefinierte
Sondengeometrie für die entsprechende Berechung zu haben, kleben wir
kleine Polystyren-Kügelchen (Durchmesser ~ 6 µm) an die Spitzen
kommerzieller Cantilever. Die entsprechenden Berechnungen werden nach dem
Hertz-Modell gemacht [6].
Durch dynamische Messungen mit einem vibrierenden Cantilever können
sogar viskose Eigenschaften durch die Bestimmung Speicher- und Verlustmodul
quantifiziert werden. In diesem Fall wird ein modifiziertes Hertz-Modell
für die Datenauswertung verwendet, welches in [7]
beschrieben wird.
Wenn dünnere Proben untersucht werden sollen, kann der Einfluss
des harten Untergrundes auf die Elastizitätsmessung nicht mehr vernachlässigt
werden und wir wenden sogenannte Tu- und Chen-Korrekturen auf das Hertz-Modell
an [8].
 |
|
| (Abbildung von Steve Pawlizak, 2009.) |
| |
Rasterkraftmikroskopie kann darüberhinaus verwendet werden um Adhäsionskräften
zwischen Zellen oder zwischen Zellen und Substrat zu messen. Dabei wird
eine adhärierte Zelle mit einem beschichteten Cantilever langsam abgerissen,
wobei die Cantilever-Verbiegung registriert wird. In unserem Labor verwenden
wir das CellHesion 200
(JPK Instruments AG, Berlin) mit einer z-Piezo-Höhe von 100 µm
für Zelladhäsionsmessungen.
Krebszellen weisen eine verringerte Adhäsionsstärke auf, welche
mit ihrer Eigenschaft zu metastasieren zusammenhängen könnte.
Wir werden die Adhäsion normaler Fibroblasten und von Fibroblasten
in unterschiedlichen Krebsstadien erforschen. Präzise Messungen der
Veränderung der Adhäsionsstärke sowie der damit verbundenen
Zytoskeletteigenschaften bösartiger Zellen wird einen neuen Einblick
in die Rolle von Zelladhäsion und Metastasenbildung liefern.
(Dieser Artikel wurde 2003-2007, 2009 von Jens
Gerdelmann,
Claudia Brunner &
Steve
Pawlizak geschrieben.)
Literaturnachweis:
|
|
|
G. Binnig, H. Rohrer, C. Gerber, E. Weibel: Tunneling
through a Controllable Vacuum Gap, Appl. Phys. Lett. 40(2):178-180
(1982). |
|
|
|
|
|
|
G. Binnig, H. Rohrer, C. Gerber, E. Weibel: Surface
Studies by Scanning Tunneling Microscopy, Phys. Rev. Lett. 49(1):57-61
(1982). |
|
|
|
|
|
|
G. Binnig, C. F. Quate, C. Gerber: Atomic
Force Microscope, Phys. Rev. Lett. 56(9):930-933 (1986). |
|
|
|
|
|
|
M. Radmacher, R. W. Tillmann, M. Fritz, H. E. Gaub: From
Molecules to Cells: Imaging Soft Samples with the Atomic Force Microscope,
Science 257(5078):1900-1905 (1992). |
|
|
|
|
|
|
F. Moreno-Herrero, J. Colchero, J. Gómez-Herrero, A.M. Baró: Atomic
force microscopy contact, tapping, and jumping modes for imaging biological
samples in liquids, Phys. Rev. E 69(3):031915 (2004). |
|
|
|
|
|
|
H. Hertz: Über die Berührung
fester elastischer Körper, Journal für die reine und angewandte
Mathematik 92:156-171 (1881).
PDF |
|
|
|
|
|
|
R. E. Mahaffy, C. K. Shih, F. C. MacKintosh, J. Käs: Scanning
probe-based frequency-dependent microrheology of polymer gels and biological
cells, Phys. Rev. Lett. 85(4):880-883 (2000). PDF |
|
|
|
|
|
|
R. E. Mahaffy, S. Park, E. Gerde, J. Käs, C. K. Shih: Quantitative
analysis of the viscoelastic properties in thin regions of fibroblasts
using AFM, Biophys. J. 86(3):1777-1793 (2004).
PDF |
|
|












